2020.06.30 - [2024 고급물리학] - [고급물리학] 열역학 ① {상태방정식, 기체 분자 운동론, 열과 일의 관계, 열역학 제1법칙, 열역학 과정}
[고급물리학] 열역학 ① {상태방정식, 기체 분자 운동론, 열과 일의 관계, 열역학 제1법칙, 열역학
학습 목표이상 기체 상태 방정식으로 이상 기체의 특성을 설명할 수 있다.기체의 내부 에너지와 온도, 압력 등을 분자 운동 모형으로 설명할 수 있다.등분배 정리를 이용하여 내부 에너지를 계
gooseskin.tistory.com
학습 목표
통계적인 관점에서의 엔트로피를 이해하고, 열역학 제2법칙을 설명할 수 있다.
판서 조직도

4. 열역학 제2법칙

일반적으로 물리학 법칙, 가령 F=ma는 시간의 방향에 무관합니다. 시간을 -로 뒤집더라도 법칙 자체에 아무런 영향을 주지 않기 때문이죠. 자유 낙하하는 물체를 촬영해서 그것을 거꾸로 돌려도 그 장면을 보고 "연직 상방 운동하는 물체구나."하고 말아버리며 필름을 거꾸로 돌렸다는 사실을 알아차리지 못할 겁니다.

하지만 유리잔이 떨어져서 깨지는 장면을 찍어서 거꾸로 돌리면 너무 이상하게 보일 겁니다. 그런 일은 현실에서 나타나지 않기 때문이죠. 사실 유리잔이 복원되는 과정은 뉴턴의 운동 법칙, 에너지 보존 법칙의 측면에서 보면 아무 문제없습니다. 그러나 단 하나의 물리 법칙을 위반해요. 바로 엔트로피 법칙, 다른 말로 '열역학 제2법칙'입니다.
1) 엔트로피와 열역학 제2법칙
시간은 변화를 기술하기 위한 가상적 개념입니다. 시간은 변화에 있어서 '무질서'를 지향하는데요. 이러한 시간의 방향을 '엔트로피(=무질서도)'라고 합니다. 다시 말해 자연에서 시간의 방향을 정해주는 것이 바로 엔트로피예요. 엔트로피는 시간이 어느 방향으로 흐르는지와 관련된 유일한 물리학 현상입니다.
이처럼 자연의 모든 것은 무질서로 귀결됨을 '열역학 제2법칙'이 설명합니다. '열역학 제2법칙'은 시간의 흐름을 일으키는 원인으로 에너지 보존 법칙에 필적할 만큼 굉장히 근본적인 법칙이에요.
2) 열역학 제2법칙에 따른 현상
자연 현상은 반드시 엔트로피가 낮은 상태에서 높은 상태로 변합니다. 그렇기 때문에 흘러가는 시간 따라 질서 정연한 상태에서 무질서한 상태로 변하기 마련입니다. 열의 이동 방향 또한 엔트로피에 의해서 정의됩니다.
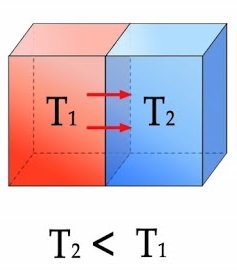
엔트로피는 열의 이동 방향을 고온에서 저온으로 정의합니다. 따라서 뜨거운 물체가 식어가는 건 자연스럽지만, 열이 저온에서 고온으로 이동하여 뜨거운 물체가 더 뜨거워지는 것은 너무나 부자연스럽죠.
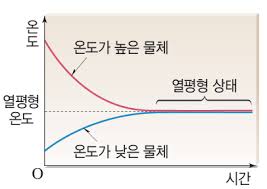
열역학 제0법칙

열은 계에 에너지를 전달하는 한 방식으로, 온도가 다른 두 물체를 접촉시키면 자발적으로 온도가 높은 곳에서 낮은 곳으로 전달되는 에너지이며, 두 계의 온도가 같아질 때까지 열 에너지는 이동합니다. 결국 두 계의 온도가 같아지게 되고, 이를 열평형 상태에 도달했다고 합니다.
5. 열기관
1) 열효율
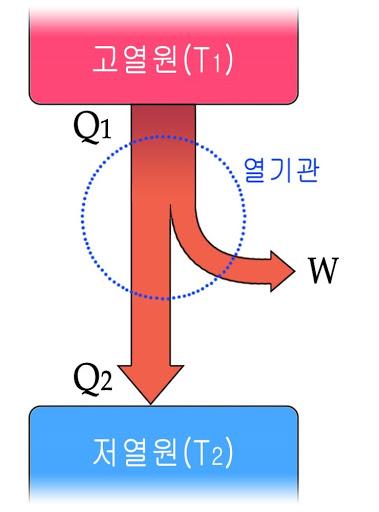
열기관은 열(Q1)을 흡수하여 그 일부를 일(W)로 바꾸어 주는 장치입니다. '에너지 보존 법칙'에 의하면 열을 모두 일로 바꿀 수 있지만 실제 기관은 투입된 열의 일부만이 일로 바뀝니다. 그 이유가 무엇일까요?
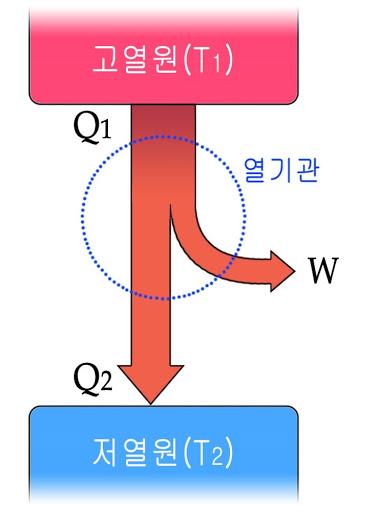
열은 온도가 높은 물체에서 온도가 낮은 물체로 이동하는 에너지입니다. 열기관은 이 흐름을 이용해서 열의 일부를 일로 전환해요. 이때 열기관의 열효율은 다음과 같습니다.

열효율이 100%인 열기관? '에너지 보존 법칙'만 고려하면 가능합니다. 버려지는 열 Q2가 0이 되어도 에너지 보존 법칙은 위배되지 않거든요. 하지만 버려지는 열이 0이 되기 위해서는 열이 자동으로 저온에서 고온으로 이동해야 하고, 이는 '열역학 제2법칙'에 어긋나요. 따라서 열효율이 100%인 열기관은 절대로 만들어질 수 없습니다. 외계인의 시어머니가 쳐들어와도. 결코. never. definitely.
열기관에서 표현되는 열역학 제2법칙
ⓐ열은 자연스러운 이동 방향은 고온에서 저온으로
ⓑ열을 모두 일로 바꾸는 것은 불가능하다.
ⓒ열효율이 1인 열기관은 없다.
ⓓ버려지는 열은 0이 될 수 없다.
2) 카르노 기관
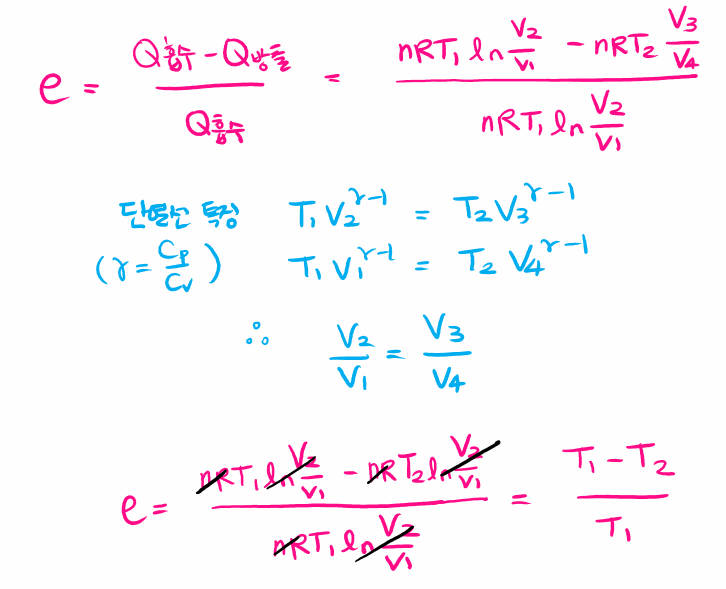
카르노 기관은 이론적으로 열효율이 제일 높은, 굉장히 이상적인 열기관입니다. 열효율은 다음과 같아요.
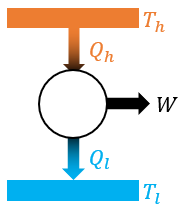

저열원의 온도가 0K 또는 고열원의 온도가 ∞가 될 수 없으므로, 카르노 기관의 열효율 역시 100%가 될 수 없습니다.
카르노기관 열효율 증명
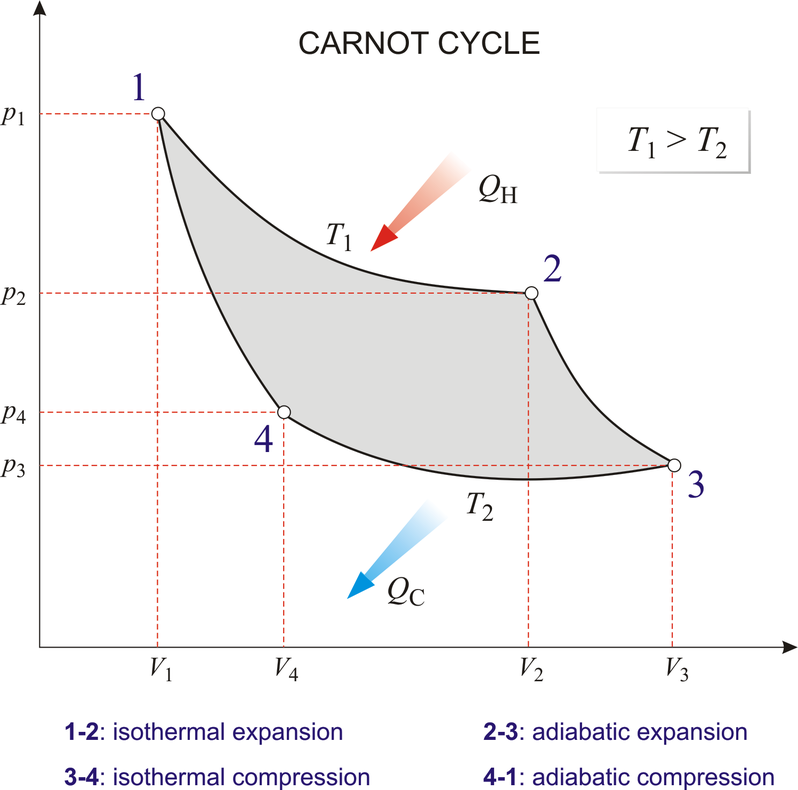
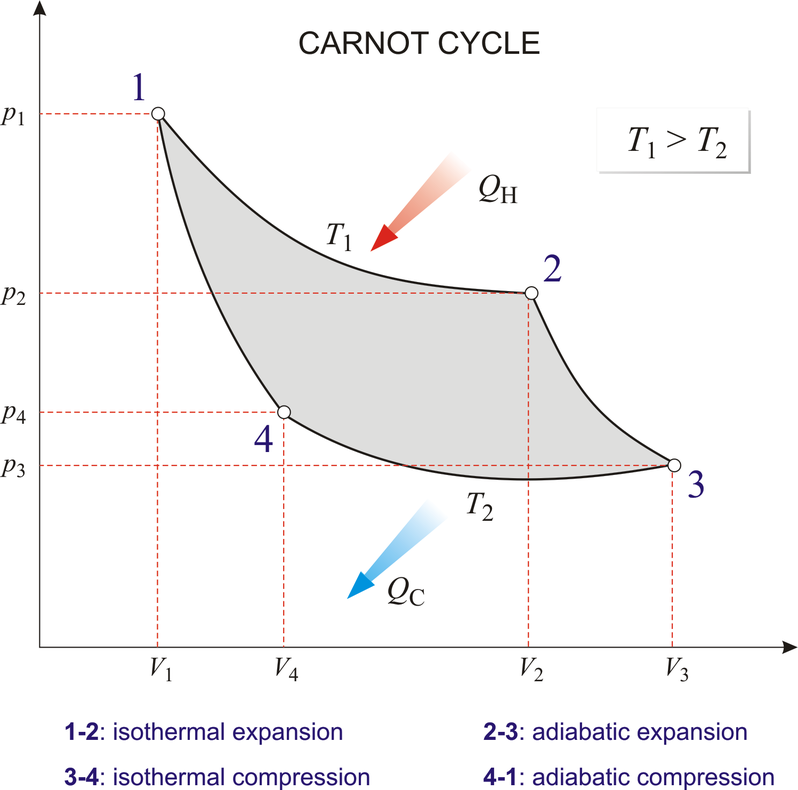
각 단계를 살펴보면 등온 팽창 과정(1→2) 동안 기체가 팽창하면서 온도가 T1인 고열원으로부터 열 QH를 흡수하고, 단열 팽창 과정(2→3)에서 외부와의 열 접촉이 차단된 상태로 기체의 온도가 T2가 될 때까지 팽창합니다. 다음 등온 압축 과정(3→4)을 통해 온도가 T2인 저열원으로 열 QC를 방출하면서 압축되고, 마지막으로 단열 압축 과정(4→1)을 통해 외부와의 열 접촉이 차단된 상태로 기체의 온도가 T1가 될 때까지 압축되어 처음 1번 상태로 되돌아갑니다.
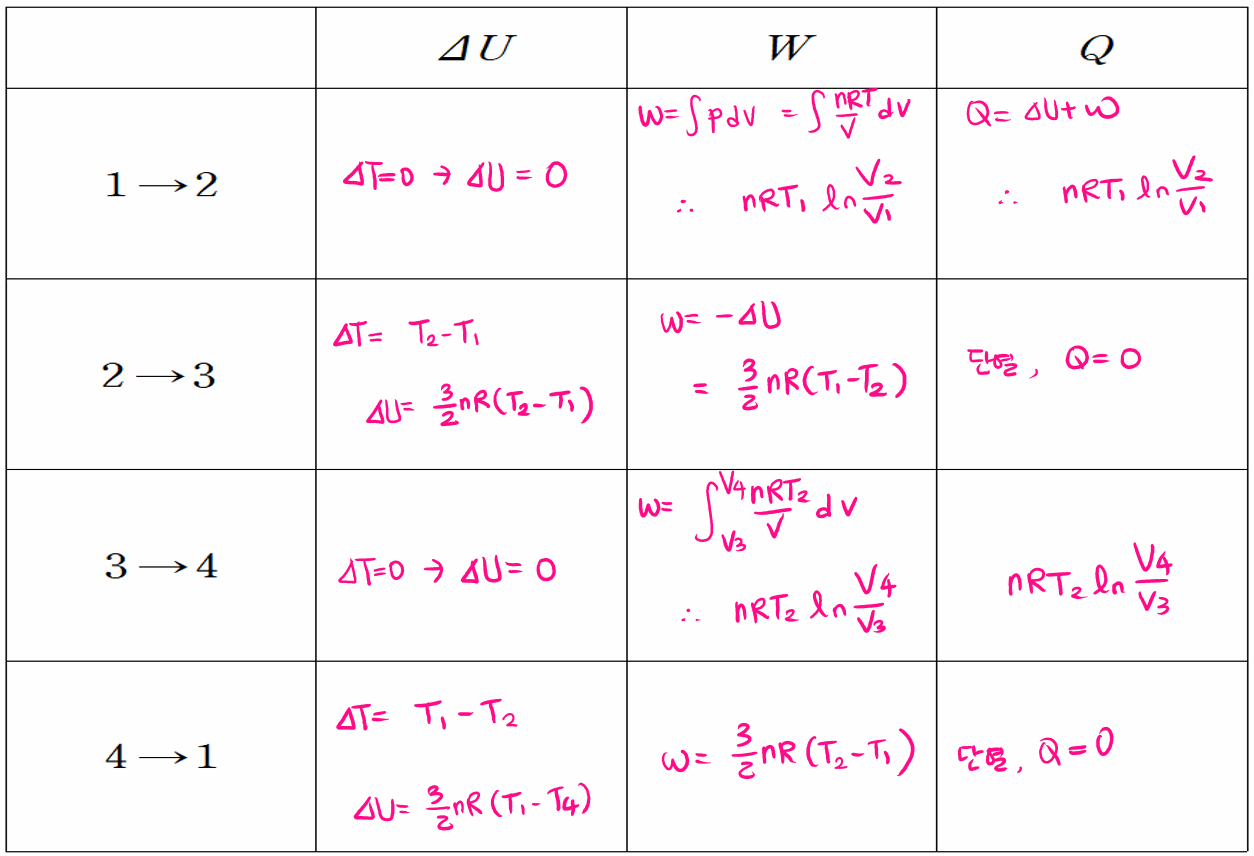
6. 엔트로피
1) 엔트로피의 정량적 접근
카르노 순환에서 내부 에너지처럼 처음 값과 나중 값이 같게 정의되는 물리량이 있습니다.
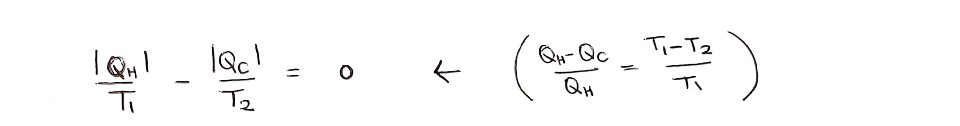
위의 식을 일반화하면
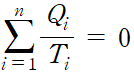
변수를 더욱 미소 단계로 나누면 다음과 같이 적분으로 나타낼 수 있습니다.
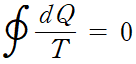
이것은 선 적분이 경로에 무관하다는 것을 나타냅니다. 스토크스 정리를 연상시킵니다.
경로에 상관없는 보존력과 스토크스 정리

따라서 Q/T의 변화량은 어떤 열역학 과정을 거치든 간에 처음 상태와 나중 상태가 같다면 같은 값으로 정의됩니다. 이 새롭게 정의된 상태함수 Q/T를 '엔트로피'라 해요.
S(엔트로피) = Q/T
엔트로피는 계에 열이 출입함에 따라 수반되는 물리량으로 계가 열을 흡수하면(Q>0) 증가하고(S>0), 열을 방출하면(Q<0) 감소(S<0)합니다. 이를 토대로 온도가 높은 물체에서 낮은 물체로 열이 이동하는 자연적인 현상을 분석해 봅시다.

높은 온도 TH인 물체에서 낮은 온도 TC인 물체로 열 Q가 이동할 때 엔트로피 변화는
△S = -Q/TH + Q/TC
TH > TC 이므로 위 식에 의거하면 항상 계의 엔트로피 변화량은 양수값이고 이는 엔트로피는 증가하는 방향으로 전개됨을 뜻합니다.
이 세상 모든 시스템은 총 엔트로피가 증가하는 방향으로 작동합니다.
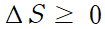
엔트로피 변화가 0인 것은 카르노 기관과 같은 이상적인 상황에 해당돼요.
열기관에서 버려지는 열이 있어야 함을 엔트로피로 설명하기
열효율이 1인 열기관은 열역학 제1법칙을 만족하지만, 열역학 제2법칙을 만족하지 못합니다. 버려지는 열이 0이 되면 열효율이 1이 될 수 있지만, 그렇게 돼버리면 전체 계의 엔트로피가 음의 값을 가져버리죠. 전체 계 엔트로피의 변화는 항상 양의 값을 가져야만 하므로 버려지는 열은 0이 되어선 안됩니다.
카르노기관보다 높은 열효율을 갖는 열기관을 만들 수 없는 이유
2023.04.25 - [대학물리학 조각] - [열역학] 카르노기관보다 높은 열효율을 갖는 열기관의 모순
[열역학] 카르노기관보다 높은 열효율을 갖는 열기관의 모순
아무리 날고 기는 기술이 개발되어도 카르노기관의 열효율을 넘어서는 열기관은 발명될 수 없다. 그 이유를 한마디로 말하자면 그러한 열기관은 '열역학 제2법칙'을 위배하기 때문이다. 다음은
gooseskin.tistory.com
2) 기체의 자유 팽창
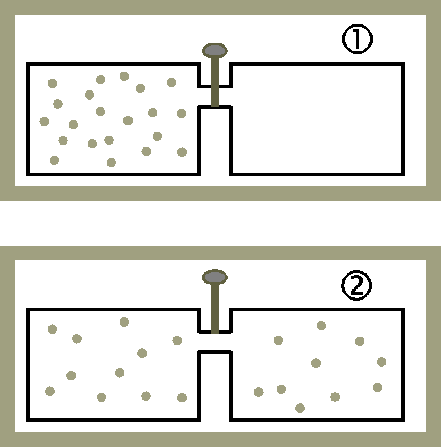
잠금장치가 열리면 왼쪽 기체가 오른쪽으로 퍼지며 고루 분포합니다. 이때 엔트로피 변화를 알아봅시다.
이때 전체 계가 단열되어 있다고 가정할게요. 그렇다면 계에 출입한 열 Q는 0이고, 기체가 하는 일 W은 0입니다. 기체 분자가 밀어낼만한 물체, 가령 피스톤 같은 것이 없기 때문이죠. 열역학 제1법칙에 의해 내부 에너지 변화 △U 역시 0입니다.
자유 팽창하는 기체의 엔트로피 변화를 구해볼게요. 자유 팽창 과정은 처음 상태와 나중 상태는 알 수 있으나 그 중간에 어떠한 상태들을 거치는지 알 수 없습니다. 그러나 엔트로피는 열역학 과정이 어떠한 경로를 거치든 상관없이 같은 상태에 도달하면 같은 값을 가지므로 자유 팽창과 비슷한 열역학적 과정을 이용하면 전체 엔트로피를 구할 수 있습니다. 기체의 처음과 나중의 온도가 같으므로 등온 과정을 이용하여 n몰의 이상 기체가 자유 팽창을 통해 계의 부피가 2배가 되었을 때의 엔트로피 변화량을 구할 수 있어요.

기체가 자유 팽창 시 엔트로피가 증가함, '△S(=nRln2)>0'을 확인할 수 있어요.
3) 엔트로피의 통계적 접근

앞에서는 열의 출입과 관련된 형태로 엔트로피의 변화를 정의하였습니다. 그런데 엔트로피를 열의 출입과 무관한 형태인 통계적 관점으로 정의하기도 해요. 자연 현상의 방향성을 상태수와 겹침수와 같은 확률적인 문제로 접근하여 열역학 제2법칙을 설명하기도 합니다.
S = klnΩ (Ω=계의 겹침수)
통계적 엔트로피 정의와 열역학적 엔트로피 정의는 표현 형태만 다를 뿐 동일한 양입니다.
온도 - 이하이
https://www.youtube.com/watch?v=Z-3tctdGOPs
선생님, 미지근한 사람이 되어주세요.
누군가 너무 차가워서 놀라거나, 너무 뜨거워서 데이지 않았으면 좋겠다며 미지근한 사람이 되어달라는 제자의 편지가 아직도 기억에 남습니다. 선생님이기에 필연적으로 많이 마주하게 될 학생들에게 최대한 덜 상처받기를 바라는 마음을 '열평형'으로 비유한 것이 고스란히 전달됐기 때문이죠. 제자의 그 예쁜 마음 덕분에 오히려 좋은 선생님이 되기 위한 제 열정은 더욱 뜨거워졌습니다.
열기관은 고온에서 저온으로 흐르는 열의 일부를 일로 바꾸어주는 장치입니다. 다시 말해 열기관이 일을 할 수 있는 이유는 열원의 온도차에 있어요. 뜨거운 열정이 차가운 현실에 식어가며 그 온도차가 0에 수렴하게 됨에 따라 나를 발전시킬 에너지의 흐름이 막혀버릴 때가 있습니다. 냉혹한 현실에도 열정(熱情)의 온도가 유지될 수 있었던 건 내 곁의 소중한 사람들이 지지해 주고 격려해 주는, 그 뜨거운(熱) 정(情)에 있었지 않나란 생각에 마음이 따뜻해집니다. 오늘도 물리를 통해 인생을 배웁니다.
'2024 고급물리학' 카테고리의 다른 글
| [고급물리학] 양자 역학 ② {불확정성 원리, 보어의 원자모형} (0) | 2024.06.20 |
|---|---|
| [고급물리학] 양자 역학 ① {흑체 복사, 광전 효과, 콤프턴 산란, 데이비슨-거머 전자 산란 실험} (4) | 2024.06.18 |
| [고급물리학] 열역학 ① {상태방정식, 기체 분자 운동론, 열과 일의 관계, 열역학 제1법칙, 열역학 과정} (4) | 2024.06.11 |
| [고급물리학] 일반상대성이론 (2) | 2024.06.10 |
| [고급물리학] 특수상대성이론 ② {질량과 에너지의 관계} (2) | 2024.06.07 |



