물리학Ⅰ 전개도

아웃라인

핵심 개념
①상태 방정식 PV = NkT ②열역학 과정 ③열기관의 열효율
목표 기출 문제
14년도 9월 모평 물리1 5번

답: 4번
14년도 4월 학평 물리1 3번

답: 4번
19년도 6월 모평 물리1 16번

답: 2번
19년도 9월 모평 물리1 3번

답: 5번
1. 기체가 하는 일과 내부 에너지
1) 기체 분자 운동에 의한 일
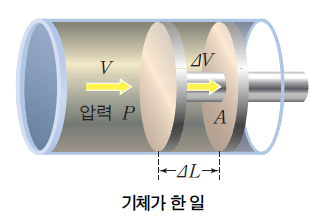

압력(P)은 단위 면적(A)에 수직으로 작용하는 힘(F)이므로 기체의 압력 P에 피스톤의 면적 A를 곱하면 기체가 피스톤에 미치는 힘 F가 된다. 이렇게 힘 F(=PA)를 가해서 피스톤이 거리 △L만큼 움직였다면 기체는 피스톤에 W = F△L = PA△L = P△V만큼의 일을 해준 것이다.
| 기체가 팽창할 때(△V>0) | 기체가 수축할 때(△V<0) | 압력과 부피가 변할 때 |
 |
 |
 |
| 기체가 외부에 W만큼의 일을 한다. (W>0) |
기체가 외부에서 W만큼의 일을 받는다. (W<0) |
부피-압력 그래프의 아래 면적이 일의 양이다. |
2) 내부 에너지
기체 분자의 역학적 에너지를 기체 분자의 '내부 에너지'라고 한다. 물리학1에선 주로 이상기체(ideal gas)의 열현상을 다루는데, 이상 기체 분자끼리는 서로 상호 작용을 하지 않기 때문에 퍼텐셜 에너지가 무시된다. 따라서 이상기체의 내부 에너지는 곧 기체 분자의 운동 에너지라고 생각하면 된다.
①절대온도 T
열역학에서는 우리에게 익숙한 온도 단위인 섭씨온도 [℃]보다는 절대 온도[K]를 사용한다. 섭씨온도를 절대 온도로 환산하려면 섭씨온도에 273을 더하면 된다. 절대온도 T[K]= 섭씨온도[℃] + 273
②온도와 내부 에너지의 관계
기체 분자의 운동 에너지는 절대 온도에 비례한다. 기체의 온도가 높다는 건 그만큼 기체 분자의 운동이 활발하다는 뜻이고, 기체의 온도가 낮다는 건 그 반대다. 따라서 기체 분자의 운동 에너지, 즉 기체의 내부 에너지는 온도에 비례한다. U(내부 에너지) ∝ T(절대 온도)
따라서 기체의 온도가 높아질 때(△T>0) 기체의 내부 에너지는 증가(△U>0)하고, 기체의 온도가 낮아질 때(△T<0) 기체의 내부 에너지는 감소(△U<0)한다.
상태 방정식, PV=NKT
상태 방정식은 물리학1에서 배우지 않지만 알아놓으면 정말 유용하게 쓰인다. 사실 처음 보는 것도 아니다. 중학교 과학 시간에 공부했던 보일-샤를 법칙이 이 상태 방정식을 근거로 설명된다.
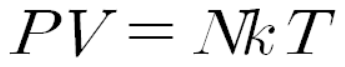
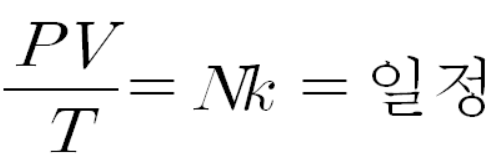
밀폐된 용기의 기체 분자수 N은 변함이 없고, k는 상수이니까 항상 일정한 값이다. 따라서 밀폐된 용기에 있는 기체의 PV/T 값은 상수이다. 이는 보일-샤를 법칙을 완벽히 설명한다.

2. 열역학 제1법칙
1) 사실은 에너지 보존 법칙
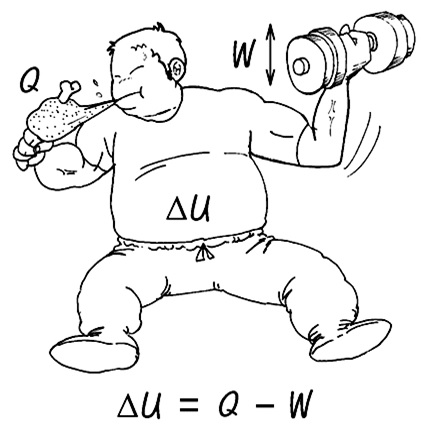
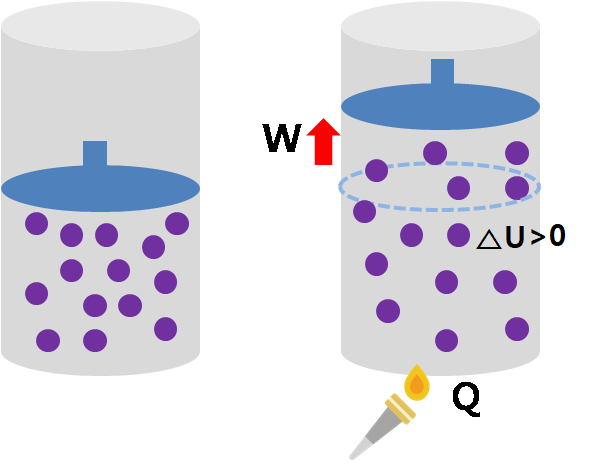
밥을 먹고(Q) 몸을 움직이면(W) 그 차이만큼의 에너지(△U)가 남는다. △U = Q - W
어떤 계(system)의 내부 에너지 변화량(△U)은 계에 출입한 열(Q)에서 기체가 한 일(W)을 뺀 양과 일치함을 알 수 있다. 이 관계를 설명하는 법칙이 '열역학 제1법칙'이다. 식을 정리하면 다음과 같다. Q=△U+W
사실 열역학 제1법칙은 열에너지와 역학적 에너지를 포함한 보다 일반화된 '에너지 보존 법칙'이다.
부호 규칙
| Q>0 계가 열을 흡수 |
Q<0 계의 열이 방출 |
| △U>0 계의 온도 증가 |
△U<0 계의 온도 감소 |
| W>0 기체가 외부에 일을 함 |
W<0 기체가 외부로부터 일을 받음 |
2) '상태 방정식'과 '열역학 제1법칙'으로 분석하는 열역학 과정
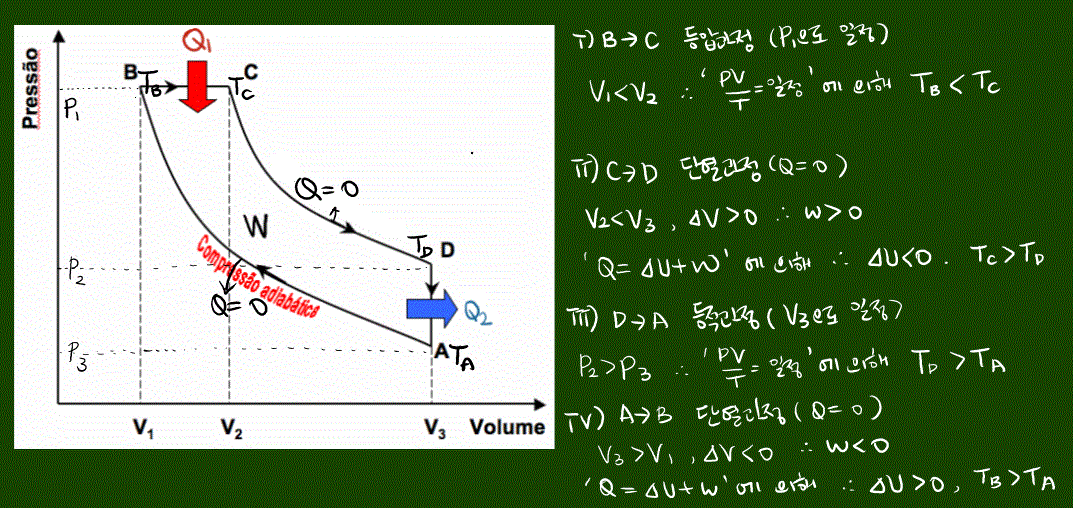
①등압 과정
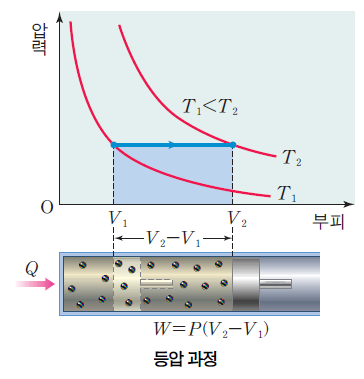
등압 과정시 압력 P가 변하지 않는다. 열역학 제1법칙 Q = △U + W(P△V) 에 의해서 열 출입이 내부 에너지와 부피의 변화에 기여하는 과정이다.

반대의 과정에서는 (압력이 일정하지만 부피가 줄어드는 경우) △V<0 이므로 W<0 이고, 온도가 감소하므로 △U<0이어서 Q<0 이게 된다. 이 경우는 계가 열을 방출한다.
②정적 과정
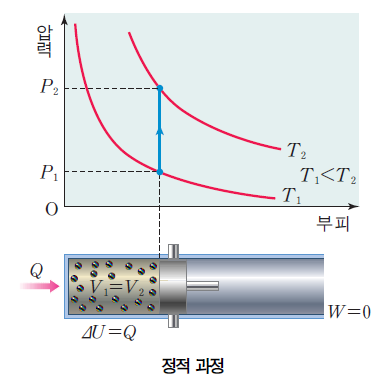
정적 과정시 부피 V가 변하지 않는다. 열역학 제1법칙 Q = △U + W(P△V) , 즉 W=0이 된다.
이 과정에서는 열 출입이 내부 에너지 변화에만 기여한다.

반대의 과정엔 온도가 감소하므로 계가 방출한 열만큼 내부 에너지가 감소한다.
③단열 과정
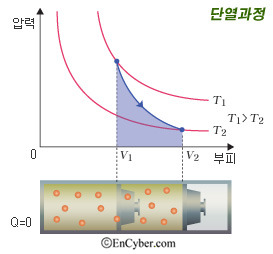
단열 과정은 외부로의 열출입이 없는 열역학 과정이다 따라서 Q=0이다. 열역학 제1법칙 Q = △U + W(P△V) 에 의해서 △U = - W 이다. 즉 기체가 외부에 일을 하면 (부피가 팽창하면) 계의 온도는 낮아지고, 기체가 외부로부터 일을 받으면 (부피가 수축하면) 계의 온도는 높아진다.

3. 열역학 제2법칙
1) 엔트로피
시간은 변화에 대한 관념이고, 변화를 기술하기 위한 가상적 개념에 지나지 않는다. 자연에서 시간의 방향을 정해주는 것이 '엔트로피'이다. 시간은 변화에 있어서 무질서를 지향한다. 이처럼 자연의 모든 것은 무질서로 귀결된다는 법칙이 '열역학 제2법칙'이다. '열역학 제2법칙'이 성립하지 않는 것은 운동량이나 에너지 보존 법칙이 성립하지 않는 것보다 더 이상한 일이다.
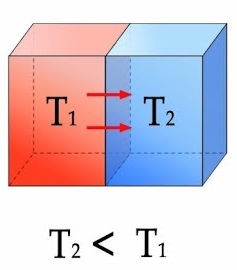
뜨거운 물체가 식어가는 건 열이 고온에서 저온으로 이동하기 때문이며 너무나 자연스러운 반응이다. 그러나 열이 저온에서 고온으로 이동하여 뜨거운 물체가 더 뜨거워지는 것은 너무나 부자연스럽다. 이처럼 엔트로피는 열의 이동 방향을 고온에서 저온으로 결정한다.
2) 열기관
ⓛ열효율
열기관은 열(Q1)을 흡수하여 그 일부를 일(W)로 바꾸어 주는 장치이다. '에너지 보존 법칙'에 의하면 열을 모두 일로 바꿀 수 있지만 실제 기관은 투입된 열의 일부만이 일로 바뀐다. 그 이유가 무엇일까?
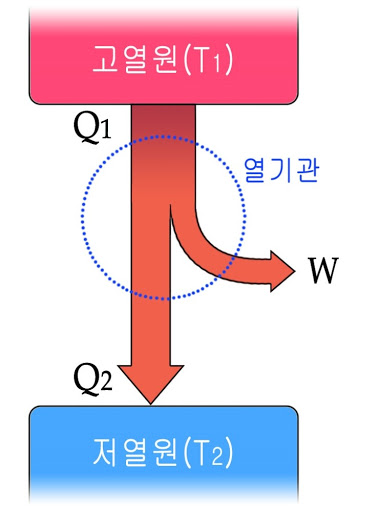
열은 온도가 높은 물체에서 온도가 낮은 물체로 이동하는 에너지다. 열기관은 이 흐름을 이용해서 열의 일부를 일로 전환한다. 이때 열기관의 열효율은 다음과 같다.
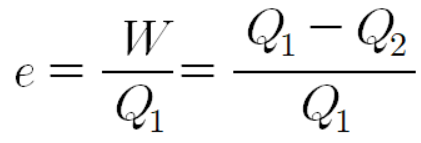
열효율이 100%인 열기관? '에너지 보존 법칙'만 고려하면 가능하다. 버려지는 열 Q2를 0으로 만들어도 에너지 보존을 위배하지는 않는다. 하지만 버려지는 열이 0이 되기 위해서는 열이 자동으로 저온에서 고온으로 이동해야 하고, 이는 '열역학 제2법칙'에 어긋난다. 따라서 열효율이 100%인 열기관은 절대로 만들 수 없다.
②카르노 기관의 열효율
카르노 기관은 이론적으로 열효율이 제일 높은, 굉장히 이상적인 열기관이다. 열효율은 다음과 같다.
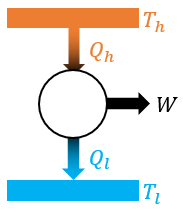
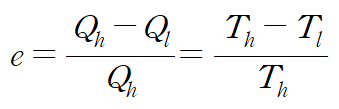
저열원의 절대 온도가 0K 또는 고열원의 절대 온도가 ∞가 될 수 없으므로, 카르노 기관의 열효율 역시 100%가 될 수 없다.
열기관의 순환 과정 분석

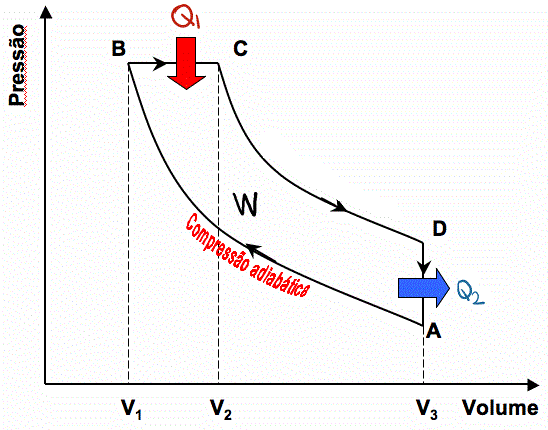
열기관이 한 번의 순환 과정을 거치면 다시 원래의 상태로 되돌아오므로, 한 번의 순환 과정 동안 열기관의 내부 에너지는 변화가 없다.

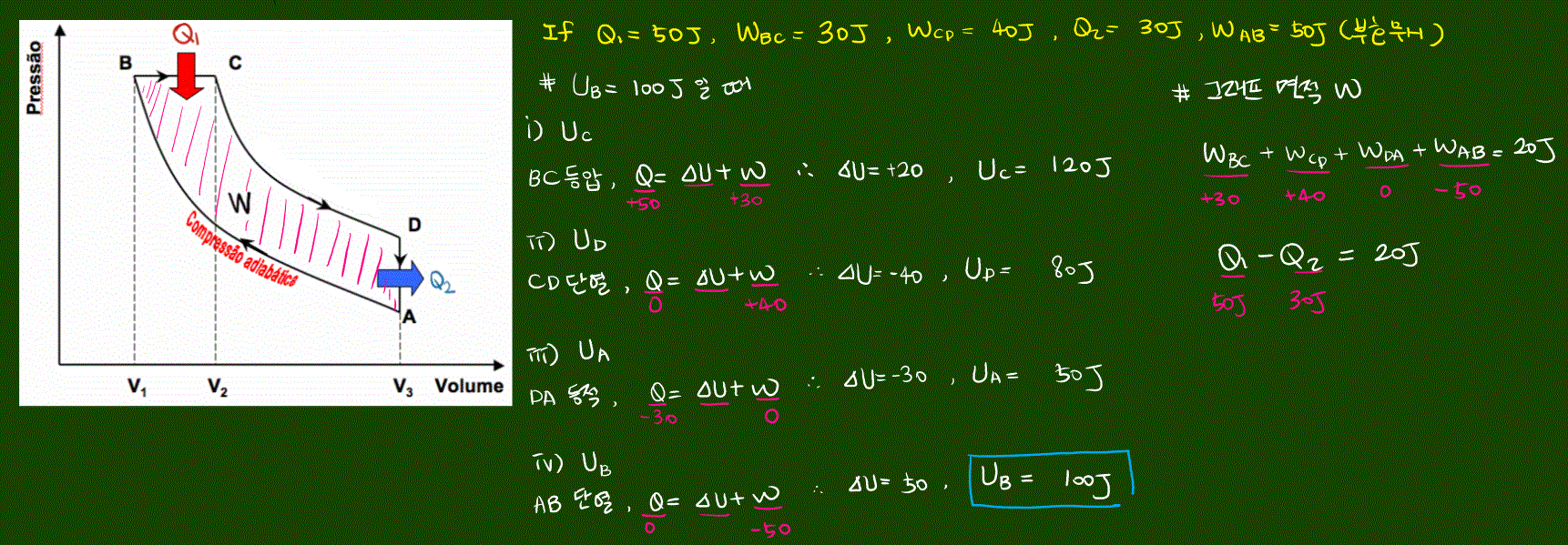
도전 기출 문제
23년도 9월 모평 물리학1 15번

답: 5번
'2023 물리학I 판서 조직도' 카테고리의 다른 글
| 원자와 전기력(쿨롱 법칙, 보어의 원자 모형) (0) | 2023.02.11 |
|---|---|
| 시공간과 에너지(동시성의 상대성, 시간 지연, 길이 수축, 질량-에너지 등가 원리, 핵반응) (0) | 2023.01.11 |
| 일과 에너지Ⅱ(키워드별 기출문제 풀이) (0) | 2023.01.08 |
| 일과 에너지Ⅰ(일-에너지 정리, 역학적 에너지) (1) | 2023.01.05 |
| 운동량과 충격량(운동량과 충격량의 관계, 운동량 보존 법칙, 상대 속도) (0) | 2023.01.04 |




사이언스토리텔러님의
글이 좋았다면 응원을 보내주세요!
이 글이 도움이 됐다면, 응원 댓글을 써보세요. 블로거에게 지급되는 응원금은 새로운 창작의 큰 힘이 됩니다.
응원 댓글은 만 14세 이상 카카오계정 이용자라면 누구나 편하게 작성, 결제할 수 있습니다.
글 본문, 댓글 목록 등을 통해 응원한 팬과 응원 댓글, 응원금을 강조해 보여줍니다.
응원금은 앱에서는 인앱결제, 웹에서는 카카오페이 및 신용카드로 결제할 수 있습니다.